- 憲法法庭要開庭!邱顯智收通知書 證實大法官將開說明會辯「性侵案追訴時效」
- 伊朗官員:若遭美國攻擊 將打擊區域內美軍基地
- 泰國起重機砸火車至少32死 目擊者驚「起重機慢慢滑下來、事故過程不到1分鐘」
- 伊朗局勢急速升溫 油價上漲金銀猛創新高點
- 政院15日討論老農津貼加碼與否 擬衡酌採納朝野版本
- 陪尪出庭太無聊!21歲女「噴酒精燒螞蟻」嚇壞眾人 新北地院虛驚
- 快訊/美軍正從卡達烏代德空軍基地撤人 預防伊朗攻擊
- 去年跟自民黨拆夥 日本公明黨考慮和最大在野黨共組新政黨
- 一起床就談格陵蘭!川普:基於國家安全、美國需要格陵蘭
- 獨家/辦「生醫界美魔女」洩密? 調查官出庭猛扯長官 調查局嗆:沒人看過
- 周杰倫澳網「被秒殺」碰不到球!輸球首發聲:只能在場邊做1事
- 川普如何幫助伊朗民眾? 專家:美軍打「這裡」等於一刀割斷德黑蘭財政動脈
- 【更新】帛琉渡假村成太子集團博奕水房 負責人50萬元交保
- 分析:伊朗局勢幾乎滿足了「革命五要件」 還差什麼能使政權垮台?
- 經濟部公布新人事 2單位副署長皆由主秘升任
- 曾是尹錫悅手下敗將 辣個男人拍板對尹「內亂罪」求處死刑
- 遭投訴壟斷市場 中國市場監理總局:調查攜程集團
- 杜拜淘金一場空要閨密賠她20萬 沒有賺一毛錢還被起訴
- 對美軍購僅3000億?國防部打臉黃國昌 曝1.25兆運用項目
- 一定要請你的朋友喝!早午餐店推「三色豆奶茶」參戰
國產疫苗VS.國際疫苗 陳時中稱二期臨床試驗人數「我勝」
國產疫苗第二期臨床試驗尚未完成,中央指揮中心即簽約採購,造成股價飆漲,引發爭議。指揮官陳時中今(5月31日)特別拿兩家國產疫苗為例,與國際四大疫苗進行比較,強調國內前二期臨床試驗人數擴大,可以確保安全性;且指稱國際在第三期試驗未做完,就已經通過緊急使用授權。
指揮中心昨(30)日首度透露,5月28已與高端、聯亞簽等兩家國內疫苗廠商簽訂疫苗採購合約,每家各500萬劑疫苗,並視未來疫情需求,納入後續擴充。
不過,兩家疫苗廠目前還在第二期臨床試驗且尚待解盲,且人體試驗樣本數太少,指揮中心就簽下預採購合約,引發外界質疑「政府急什麼?」陳時中今提出三點說明。
一、國內有能力自行生產 政府也要參與投資
對此,陳時中今指出,疫苗自製自用是國家既定政策,未來新冠肺炎流感化是必然的趨勢,國家必須掌握新冠疫苗為戰略物資。國內需要有能力自行生產,政府也要參與投資,提早簽約是為讓廠商壓力減輕,增加研發動機。
陳時中還表示,本次所有疫苗,包括政府之前對外採購的國外疫苗,均為預採購模式。針對英國牛津(AZ)疫苗及莫德纳 (Moderna)疫苗,皆是在第二或第三期臨床實驗未完成前,即進行預採購。
二、國產前二期試驗樣本數大於國外藥廠
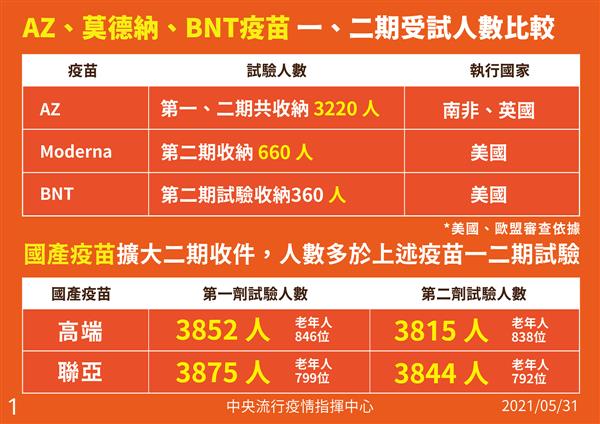
針對外界質疑國產疫苗在一、二期收案人數過少,陳時中說明,AZ疫苗第一、二期收3220人;莫德納第二期收660人、BNT第二期收360人。國產疫苗擴大二期收案人數都多於上述三廠牌,高端第一劑3852人、第二劑3815人;聯亞第一劑3875人、第二劑3844人,「以這樣規模,大致上二期做的是安全性,如果能通過的話,安全性就不會有問題。」
三、三期完成搶疫苗「來不及」
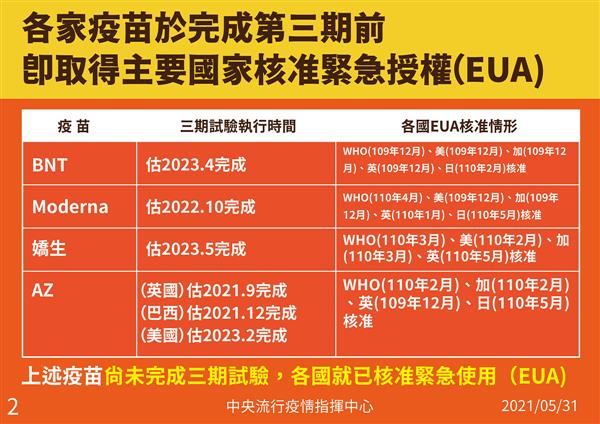
陳時中還強調,其實三期臨床試驗需要很長時間,如果等三期完成才授權、進行採購,恐怕「緩不濟急」。例如輝瑞疫苗第三期試驗結果估計2023年4月才能出爐,世界衛生組織(WHO)、美國、加拿大、英國大多在2020年12月就核准緊急使用(EUA)。
- 反年改出包…公務員退休金沒變多!翁曉玲「沒寫施行日期」回應了
- 北海道酒吧「牆藏女屍」長相曝光 28歲護理師死因出爐
- 【一文看懂】陳志到底是誰?詐騙、賭博、洗錢手法大破解 太子集團「從零到富可敵國」
- 【一文看懂】可寧衛「7天飆漲逾六成」 土方之亂「神助攻」8422!它是做什麼?
- 劇烈晃動!阿諾在中國被偷拍影片瘋傳 認了隆乳:挺起來更有底氣
- 頭皮發麻!北海道酒吧藏女屍 老闆狂開5台空氣清淨機問客:有味道嗎
- 川普如何幫助伊朗民眾? 專家:美軍打「這裡」等於一刀割斷德黑蘭財政動脈
- 快訊/時隔5年首見短絀!全年稅收3兆7515億元 短徵505億元
- 讓出17號背號收保時捷跑車 道奇推文祝福投手凱利完成13年賽季
- 道奇內野陣容年齡老化 美媒:應該留下金慧成